创新药研发再迎政策利好!临床试验申请审评审批拟缩减至30个工作日
审评时限不断压缩

近年,国家政策持续深化药品审评审批制度改革,提升药品审评审批效能,支持创新药研发。
2024年7月,国家药品监督管理局下发《关于印发优化创新药临床试验审评审批试点工作方案的通知》。该通知提出,优化创新药临床试验审评审批机制,强化药物临床试验申请人主体责任,提升药物临床试验相关方对创新药临床试验的风险识别和管理能力,探索建立全面提升药物临床试验质量和效率的工作制度和机制,实现30个工作日内完成创新药临床试验申请审评审批,缩短药物临床试验启动用时。
今年1月,国务院办公厅的发布《意见》也提出,提高药品医疗器械审评审批质效,优化临床试验审评审批机制。具体而言,要求省级药品监管部门提出申请,国家药品监督管理局同意后,在部分地区开展优化创新药临床试验审评审批试点,将审评审批时限由60个工作日缩短为30个工作日。医疗器械临床试验审评审批时限由60个工作日缩短为30个工作日。优化生物等效性试验备案机制。
此后,多地出台相关文件,推动创新药高质量发展,提升审评审批效能。
今年4月,北京市九部门联合发布的《北京市支持创新医药高质量发展若干措施(2025年)》提出:深化创新药临床试验审评审批试点,将审批时限由60个工作日压缩至30个。创新药试点品种持续扩大,试点范围扩大到医疗器械。深化药品补充申请审评审批试点,将审评时限由200个工作日压缩至60个,争取将试点范围扩大至仿制药申请。
此次《征求意见稿》明确提出,对符合要求的创新药临床试验申请在30个工作日内完成审评审批。医药产业资深经理人杜臣向时代周报记者分析指出,临床试验审评审批环节为30个工作日,已达到欧盟和美国的临界线。近5年,我国的临床试验审评审批时间也大幅缩短,从此前的几年缩短至几个月,但目前还未达到30个工作日的水平。
杜臣还表示,这显示出监管部门对创新药行业的支持不会改变,CDE继续提升审评审批效率不会改变;同时,政策导向也要求创新药企业继续关注疾病谱的变化,近年更为关注儿童用药、罕见病用药、进口药替代,以及重大疾病和流行病用药。此外,因时间缩短,药企要继续提升创新药临床申报的规范性,关注政策和流程的变化。
《征求意见稿》也对药物临床试验申请人的主体责任进行规定。首先,纳入30日通道的药物临床试验申请人向国家药品监督管理局药品审评中心提交申报资料,证明已充分考查药物临床试验机构组长单位的伦理审查、主要研究者能力和合规情况。
其次,是在提交临床试验申请前,已与药物临床试验机构开展合作,同步开展项目立项、伦理审查。此外,要具备与申报品种研发风险相适应的研制环节风险评估和管理能力,并承诺在获批后12周内启动临床试验(首个受试者签署知情同意书)。
《征求意见稿》也提出,纳入创新药临床试验审评审批30日通道的申请由于需召开专家会等技术原因,无法在30日内完成审评审批的,国家药品监督管理局药品审评中心及时告知申请人,后续时限按照60日默示许可执行。
针对临床急需刚需
《征求意见稿》提出,符合资质的药物应当为中药、化学药品、生物制品1类创新药,主要包括三类:一是国家支持的重点创新药;二是入选国家药品监督管理局药品审评中心儿童药星光计划、罕见病关爱计划的品种;三是全球同步研发品种。
对于上述条件要求,刘检认为,无论是重大罕见病、儿科急需用药,还是全球同步研发,都是解决当前的急需和刚需。对于重大罕见病,我国药企此前主要跟随国际上的研发和仿制,而并未真正从本国国情出发。而如今随着社会经济发展和人口变化,疾病谱系发生变化,尤其是老龄化社会的到来,更多的罕见病引起大家关注。
刘检还介绍,儿科用药临床中一直是急需和刚需,尤其当下需要鼓励生育,首先要有良好的育儿环境,其中医疗需求不可或缺。然而目前我国临床中儿科用药很少,特别是缺乏儿科新药,多为成人用药用于儿科的情况。
上述条件规定也对创新药研发企业提出更高要求。刘检指出,儿科用药及罕见病用药首先对企业的营运能力提出很高要求。儿科及罕见病用药的患者招募是一大难题,招募患者入组课题和临床往往很难做到,也催生出市场中大量的外包公司和不规范的患者招募,因此对企业在这类市场的患者开发能力提出很高要求。
不过,刘检也指出,绿色通道的开通下,众多药企跃跃欲试,“良币”和“劣币”各显神通,将会面临千军万马过独木桥的局面。30天的审评审批执行起来相对难度较大,可能会面临企业排队的问题,例如全国能够开展临床试验的定点医院资源有限,难以满足所有企业的要求,或会出现拥挤排队。
杜臣则认为,这对创新药企和CDE在申报和审评方面都提出了更新的要求。审评审批时间缩短的同时还需要保证质量,可能需要在流程中提升效率,或者砍掉部分与药品疗效和质量无关的环节,在未来可能会面临取舍问题,药企需要及时关注相关变化。
相关文章
“抗炎养生”姜黄饮走红!盒马、山姆等争相入局,有产品调节口味变“糖分刺客”
红星资本局12月8日消息,姜黄饮近日在各大社交平台走红,并被称为“液体黄金”,盒马、山姆都推出了相关产品,盒马相关产品一度卖断货。此外,迈胜推出姜黄饮,OATLY推出姜黄燕麦奶,还有多个聚焦姜黄产品的...
B站Q3营收76.9亿,连UP主也开始赚钱了?
“一年前,哔哩哔哩实现非公认会计准则下的扭亏为盈。今年业务规模持续增长,财务表现显著改善。”哔哩哔哩首席财务官樊欣表示。 北京时间11月13日(美东时间11月13日),哔哩哔哩(以下简称“B站”)公布...
他,高中毕业做芯片,让全球60多个国家疯抢
这绝对是今年最精彩,也最颠覆认知的逆袭。 一个只有高中学历的中国人,竟然干出了一家世界级的芯片公司—江波龙。 从9月底到现在,江波龙股价最高翻了三倍多,总市值最高冲到1300亿以上。刚刚过去的第三季度...
货拉拉为什么不请这帮人代言
*此节目由豆包AI播客生成 前两天看到范曾女儿范晓蕙发微博说找不到自己爹了。 说起来也有意思,一直说和范曾有联系的她,真正去捉急是从“朋友转来网络关于家父报道”开始,也就是网传的87岁范曾被37岁的...
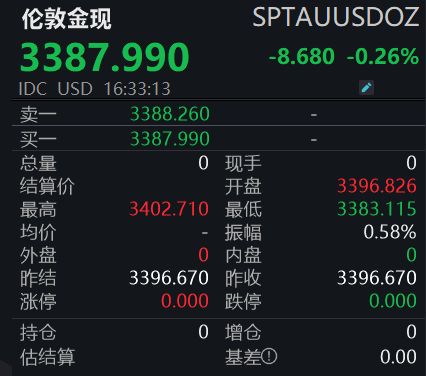
金价冲高回落,怎么回事?
7月22日,伦敦金现盘中创月度新高,触及3402.71美元/盎司。随后,金价震荡走低,失守3400美元/盎司大关。截至记者发稿,伦敦金现报3387.99美元/盎司。 值得注意的是,前一日,国际金价刚...
涂建华在北京、香港发起了诉讼!
隆鑫的重组,涂建华再次表示了反对。 5月22日,经济观察报报道,其从隆鑫集团创始人涂建华处了解到,作为隆鑫集团出资人,同时也是债权人,他对隆鑫集团等十三家公司的破产重整存有异议,认为在重整过程中,其...




 豫ICP备2024079567号-1
豫ICP备2024079567号-1